|

根据《上饶市医疗设备器械采购内控工作监督管理办法(试行)》的具体要求,现对上饶市中心血站拟采购的核酸检测试剂盒、酶免检测试剂盒采购进行公开询价。本次公开征询情况将作为采购人编制政府采购招标文件最高限价、主要技术指标及配置的参考依据,欢迎广大符合要求的生产企业及经营企业积极参与。现将有关事项公告如下:
一、询价项目内容项目及需求
序号 | 品目 | 数量 | 主要技术指标(基本配置和功能要求) | 备注 |
核酸检测试剂盒、酶免检测试剂盒 | 1台 | 附后 |
主要技术指标、参数
核酸检测试剂参数
1、96测试/盒,用于检测献血者血清/血浆样本中的HBV、HCV及HIV病毒,产品含样本混样、核酸提取、扩增、检测等所需的试剂及耗材。
2、基于实时多色荧光PCR检测原理。
3、混样检测,标本的混样数量要求≥5个标本/pool。
4、可对HBV、HCV及HIV病毒进行单管实时检测与鉴别,一次检测即可鉴别HBV、HCV、HIV三种病毒。
5、基因型/亚型和突变的覆盖要求: 5.1 HIV-1 M组A-G、J亚型、O组; 5.2 HIV-2; 5.3 HCV 1-6亚型; 5.4 HBV A-F所有亚型;
6、对HBV、HCV和HIV的分析敏感性(95%最低检出限)要求:HIV-1(M组)≤51IU/mL,HIV-1(O组)≤20 拷贝/mL,HIV-2≤8IU/mL,HCV≤7IU/mL,HBV≤ 3IU/mL
7、质量控制:同时提供内标(Internal Control)和配套质控品,其中,内标可监控核酸提取和扩增检测的全过程。
8、采用国际标准的UNG酶,以防止扩增产物污染,避免假阳性。
9、试剂各组分均在2~8℃范围保存,直接使用,无需人工配制或复溶。
10、试剂盒各组分有条码标识,设备可自动扫描识别并进行跟踪。
11、原始试剂瓶直接上机,核酸提取、扩增检测过程中,试剂瓶、样本管和反应管全程封闭。
12、检测结束后,系统自动判读和传输结果,无需人工干预。
13、配套设备自动化程度高,最大耗材装载量可支持>5个小时的无人值守及过夜检测。
14、试剂须与Roche COBAS S201 系统适配。
核酸检测试剂参数
1、检测原理:PCR-荧光法。
2、检测模式:HBV/HCV/HIV-1+2联合检测。
3、适用性:与罗氏Cobas@5800核酸检测系统适配。
4、适用标本:血清或EDTA、ACD、CPD、CPDA抗凝的血浆。
5、检测性能:HBV A-H及Pre-core区突变;HCV 1-6亚型;HIV-1 M组、O组、N组;HIV-2 A、B亚型。HBV DNA≤ 1.5IU/ml; HCV RNA≤7IU/ml,HIV-1(M组)RNA≤30IU/ml; HIV-1 O组RNA≤10copies/mL ;HIV-2 RNA≤4IU/ml;
6、检测与鉴别:能够在同一反应管内进行乙肝病毒DNA、丙肝病毒RNA、人类免疫缺陷病毒RNA三项联合检测,可同时检测和区分HBV、HCV、HIV感染
7、试剂使用:扩增检测试剂各组分均在2-8℃下保存,直接使用,无需人工配制或复溶。
8、防污染:AmpErase-dUTP配对系统防止产物污染,有专用废液收集板,且试剂与样本移液通道分开独立,扩增板有专用卸载位设计,以降低污染风险
9、双靶点检测HIV-1,双探针检测HCV,提高对变异株检测的可靠性。
10、试剂有效期:24个月。
1、
96T/盒,用于检测血清/血浆中的乙型肝炎病毒表面抗原(HBsAg)。
检测方法:酶联免疫两步检测法。
试剂批内、批间变异系数(CV)小于15%;试剂特异性≥95%、灵敏度≥99%。
试剂盒所配96孔微孔板必须符合标准(12条,每条8孔),适合全自动酶免分析系统、酶标仪和洗板机使用。
试剂盒内各种组份齐全和足量,用户不需配制,适用于全自动酶免分析系统检测和手工检测。
如有加样本稀释液步骤,要求加样本后有变色反应,避免漏加样。
2、初检丙肝抗体诊断试剂盒
(1)96T/盒,用于检测血清/血浆中的丙型肝炎病毒抗体(抗-HCV)。
(2)检测方法:酶联免疫两步检测法。
(3)试剂批内、批间变异系数(CV)小于15%;试剂特异性≥95%、灵敏度≥99%。
(4)试剂盒所配96孔微孔板必须符合标准(12条,每条8孔),适合全自动酶免分析系统、酶标仪和洗板机使用。
(5)试剂盒内各种组份齐全和足量,用户不需配制,适用于全自动酶免分析系统检测和手工检测。
(6)如有加样本稀释液步骤,要求加样本后有变色反应,避免漏加样。
3、初检梅毒螺旋体抗体诊断试剂盒
(1)96T/盒,用于检测血清/血浆中的梅毒螺旋体抗体。
(2)检测方法:酶联免疫两步检测法。
(3)试剂批内、批间变异系数(CV)小于15%;试剂特异性≥95%、灵敏度≥99%。
(4)试剂盒所配96孔微孔板必须符合标准(12条,每条8孔),适合全自动酶免分析系统、酶标仪和洗板机使用。
(5)试剂盒内各种组份齐全和足量,用户不需配制,适用于全自动酶免分析系统检测和手工检测。
(6)如有加样本稀释液步骤,要求加样本后有变色反应,避免漏加样。
4、初检HIV抗原抗体诊断试剂盒(四代)
(1)96T/盒,用于检测血清/血浆中的人类免疫缺陷病毒抗体(HIV-1、2型抗体)和P24抗原。
(2)检测方法:酶联免疫两步检测法。
(3)试剂批内、批间变异系数(CV)小于15%;试剂特异性≥95%、灵敏度≥99%。
(4)试剂盒所配96孔微孔板必须符合标准(12条,每条8孔),适合全自动酶免分析系统、酶标仪和洗板机使用。
(5)试剂盒内各种组份齐全和足量,用户不需配制,适用于全自动酶免分析系统检测和手工检测。
(6)如有加样本稀释液步骤,要求加样本后有变色反应,避免漏加样。
1、复检乙型肝炎病毒表面抗原诊断试剂
(1)96T/盒,用于检测血清/血浆中的乙型肝炎病毒表面抗原(HBsAg)。
(2)检测方法:酶联免疫两步检测法。
(3)试剂批内、批间变异系数(CV)小于15%;试剂特异性≥95%、灵敏度≥99%。
(4)试剂盒所配96孔微孔板必须符合标准(12条,每条8孔),适合全自动酶免分析系统、酶标仪和洗板机使用。
(5)试剂盒内各种组份齐全和足量,用户不需配制,适用于全自动酶免分析系统检测和手工检测。
(6)如有加样本稀释液步骤,要求加样本后有变色反应,避免漏加样。
2、复检丙型肝炎病毒抗体诊断试剂
HCV ELISA双抗原夹心
(1)96T/盒或192T/盒,用于检测血清/血浆中的丙型肝炎病毒抗体(抗-HCV);原理:采用酶联免疫吸附法,双抗原夹心法
(2)加样量≥50µl;
(3)试剂批内、批间变异系数(CV)小于15%;试剂特异性≥95%、灵敏度≥99%,
(4)试剂盒所配96孔微孔板必须符合标准(12条,每条8孔),适合全自动酶免分析系统、酶标仪和洗板机使用。
(5)试剂盒内各种组份齐全和足量,用户不需配制,适用于全自动酶免分析系统检测和手工检测。
(6)如有加样本稀释液步骤,要求加样本后有变色反应,避免漏加样。
3、复检人类免疫缺陷病毒抗体诊断试剂
(1)96T/盒,用于检测血清/血浆中的人类免疫缺陷病毒抗体(HIV-1、2型抗体)。
(2)检测方法:酶联免疫两步检测法。
(3)试剂批内、批间变异系数(CV)小于15%;试剂特异性≥95%、灵敏度≥99%。
(4)试剂盒所配96孔微孔板必须符合标准(12条,每条8孔),适合全自动酶免分析系统、酶标仪和洗板机使用。
(5)试剂盒内各种组份齐全和足量,用户不需配制,适用于全自动酶免分析系统检测和手工检测。
(6)如有加样本稀释液步骤,要求加样本后有变色反应,避免漏加样。
4、复检梅毒螺旋体抗体诊断试剂
(1)96T/盒,用于检测血清/血浆中的梅毒螺旋体抗体。
(2)检测方法:酶联免疫两步检测法。
(3)试剂批内、批间变异系数(CV)小于15%;试剂特异性≥95%、灵敏度≥99%。
(4)试剂盒所配96孔微孔板必须符合标准(12条,每条8孔),适合全自动酶免分析系统、酶标仪和洗板机使用。
(5)试剂盒内各种组份齐全和足量,用户不需配制,适用于全自动酶免分析系统检测和手工检测。
(6)如有加样本稀释液步骤,要求加样本后有变色反应,避免漏加样。
人类T淋巴细胞白血病病毒抗体检测试剂盒参数
1.产品要求:需取得国家CFDA的批准文号,具有国食药监医疗器械注册证书编号;
2.功能要求:同时检测人血清或血浆中的T淋巴细胞白血病病毒HTLV-1型和HTLV-2型抗体(以说明书内容为准);
3.检验原理:采用双抗原夹心酶联免疫吸附法实验原理;
4.储存条件及有效期:试剂盒于冷藏温度(2-8℃)保存时,有效期不少于(可包含)12个月;
5.核心技术:采用双抗原夹心法原理,微孔板上预包被HTLV(1+2)型的基因重组抗原;
6.检测时,总反应时间不高于100分钟,加酶标试剂之前无需洗板;
7.随试剂提供适宜浓度的质控品,质控品应符合国家有关医疗器械的资质要求。
8.投标产品在国内血站有超过五年以上的使用经验。
二、公告时间
2025年 5月 14日— 2025年 5月16日
三、报名时间、地点及方式
1.时间:2025年5月16日17时前
2.地点:上饶市中心血站办公室
3.报名方式:
(1)现场报名,同时递交法人授权委托书、参询代表身份证复印件及产品相关授权书复印件等印证材料。
(2)外地参询企业可以电话报名,相关印证材料邮寄或电子版发送。
4.联系人及联系方式:陈 0793-8156920
4.1邮箱及邮寄地址:srxz516@126.com,上饶市信州区兴隆路1号 上饶市中心血站办公室 陈先生收
5.所有符合报名条件的机构均可参加报名,采购人不得以任何理由拒绝。
6.监督电话:
0793-8177301市医疗设备器械采购领导小组办公室
0793-8177261市纪委监委驻卫健委纪检组办公室
四、价格征询会时间、地点
时间:(另行通知)
地点:(另行通知)
五、参询单位需提供的相关材料
1、响应函及参询资料真实性承诺函;
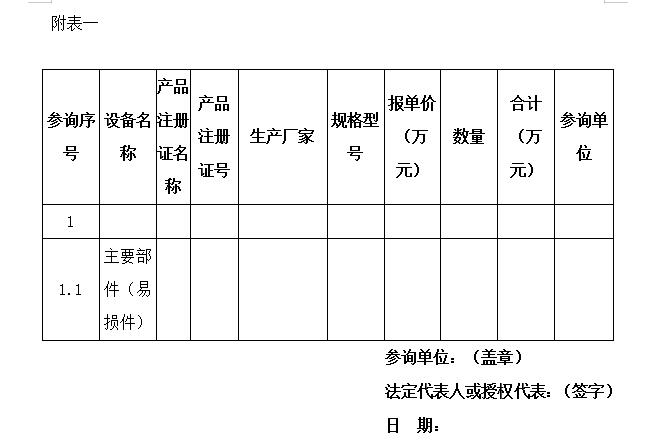
2、询价品种报价表(格式见附表1);
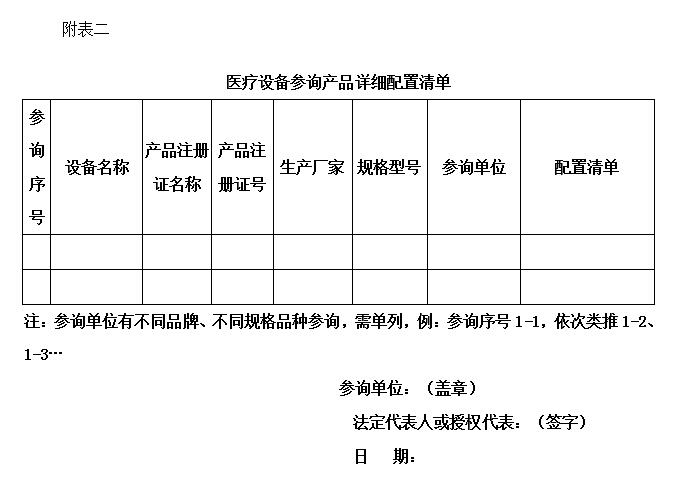
3、产品详细配置清单(格式见附表2);
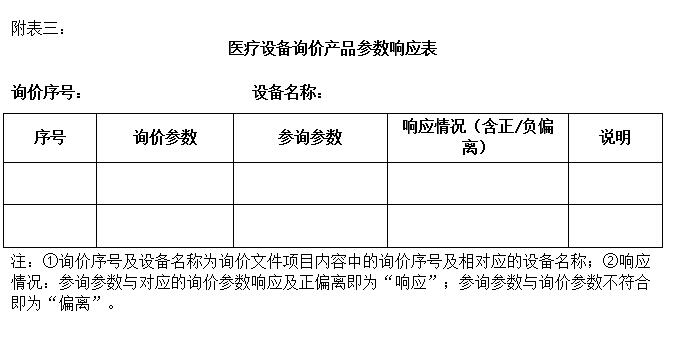
4、参询产品的参数响应表(据实提供实际参数值,有正/负偏离请标注并予以说明)(格式见附表3);
5、参询产品的详细参数和功能介绍(需提供加盖产品生产厂家公章的原厂详细产品技术参数说明书)及产品的彩页;
6、参询产品的相关资质证明材料
6.1生产企业营业执照(三证合一证)复印件;
6.2生产企业《医疗器械生产企业许可证》或《医疗器械经营企业许可证》复印件;
6.3医疗器械产品注册证及注册登记表复印件;
6.4应提交全面、详细的售后服务方案及承诺书(包含安装、调试、运行、验收、故障响应时间等),方案合理、可操作。加盖生产厂家及供应商公章;
7、产品业绩材料:需提供与参询产品同规格的产品中标公告或销售合同复印件及能体现产品临床使用评价、品牌知名度、市场占有率的相关印证材料;
8、参询企业的资质证明材料
8.1营业执照(三证合一证)复印件;
8.2《医疗器械生产企业许可证》或《医疗器械经营企业许可证》复印件;
8.3法人授权委托书、参询代表身份证复印件;
8.4进口产品需附产品授权书。
参询材料分开装订,一正两副共三份加盖参询单位公章,参询方在参加征询会时现场递交。
六、参询文件编制的注意事项
1.1参询单位应认真、仔细阅读征询公告中所有的事项、格式、条款和规范等要求。
1.2参询人应以无线胶装的形式按参询文件的格式要求按顺序编制目录及页码装订成册,否则材料丢失引起的后果自负。
1.3参询文件分为正、副本,副本可为正本的复印件。
1.4参询文件及往来函件均须用中文书写。
1.5参询人应按要求,规范、明确、准时的提交参询材料。如果没有按照征询公告要求提交全部资料并保证所提供全部资料的真实性,其风险由参询方自行承担。
1.6参询方应根据参数需求如实编制参数响应表,提供产品实际参数值并标明正负偏离。如虚假响应,视情节轻重取消该企业本次参询资格或纳入失信企业名单。纳入失信名单的企业将不得再次在本区域内参加设备参询。
七、参询文件编制的注意事项
1.1参询企业可就询价项目中某个产品或全部产品进行参询报价,报价表每个参询产品分开填报。
1.2参询人如有不同品牌、不同规格产品参询,可分别报价;所参询品种含设备易损件及主要部件,需同时报价。
1.1价格征询会由上饶市中心血站采购领导小组指定人员主持,邀请所有参询方、专家组成员参加,驻委纪检监察部门对征询会全过程进行监督,参询方的代表人员应签到以证明其出席。
1.2 在纪检监察部门监督下,从专家库随机抽取2名医疗专家、1名医装备专家共计3名专家组成临时专家组,并由专家组成员推荐一名专家为此次价格征询会专家组组长。
1.3、价格征询应做好记录。
九、评审原则与标准
1.1 征询公告、参询材料及相关的法律法规为评审依据。
1.2科学评估、集体决策,体现公开、公平、公正。
1.3质量优先、价格合理、售后有保障。
1.4以综合评价为原则,性价比优先。
上饶市中心血站
2025年 5月13日